Majalah Farmasetika – Hadiah Nobel Fisiologi atau Kedokteran 2023 diberikan untuk penemuan tentang modifikasi basa nukleosida yang memungkinkan pengembangan vaksin mRNA yang efektif melawan COVID-19.
Penemuan oleh dua Peraih Nobel yakni Katalin Karikó dan Drew Weissman ,sangat penting untuk mengembangkan vaksin mRNA yang efektif melawan COVID-19 selama pandemi yang dimulai pada awal 2020. Melalui temuan inovatif mereka, yang secara mendasar telah mengubah pemahaman kita tentang bagaimana mRNA berinteraksi dengan sistem kekebalan tubuh kita, para pemenang berkontribusi pada tingkat pengembangan vaksin yang belum pernah terjadi sebelumnya selama salah satu ancaman terbesar bagi kesehatan manusia di zaman modern.
Vaksin sebelum pandemi
Vaksinasi merangsang pembentukan respons imun terhadap patogen tertentu. Ini memberi tubuh awal yang baik dalam memerangi penyakit jika terjadi paparan di kemudian hari. Vaksin berdasarkan virus yang terbunuh atau dilemahkan telah lama tersedia, dicontohkan oleh vaksin terhadap polio, campak, dan demam kuning. Pada tahun 1951, Max Theiler dianugerahi Hadiah Nobel dalam Fisiologi atau Kedokteran untuk mengembangkan vaksin demam kuning.
Berkat kemajuan dalam biologi molekuler dalam beberapa dekade terakhir, vaksin berdasarkan komponen virus individu, bukan virus utuh, telah dikembangkan. Bagian dari kode genetik virus, biasanya menyandikan protein yang ditemukan pada permukaan virus, digunakan untuk membuat protein yang merangsang pembentukan antibodi penghambat virus. Contohnya adalah vaksin terhadap virus hepatitis B dan human papillomavirus. Atau, bagian dari kode genetik virus dapat dipindahkan ke virus pembawa yang tidak berbahaya, “vektor.” Metode ini digunakan dalam vaksin melawan virus Ebola. Ketika vaksin vektor disuntikkan, protein virus yang dipilih diproduksi dalam sel kita, merangsang respons kekebalan terhadap virus yang ditargetkan.
Memproduksi vaksin berbasis virus, protein, dan vektor utuh membutuhkan kultur sel skala besar. Proses intensif sumber daya ini membatasi kemungkinan produksi vaksin yang cepat sebagai respons terhadap wabah dan pandemi. Oleh karena itu, para peneliti telah lama berusaha mengembangkan teknologi vaksin yang independen dari kultur sel, tetapi ini terbukti menantang.
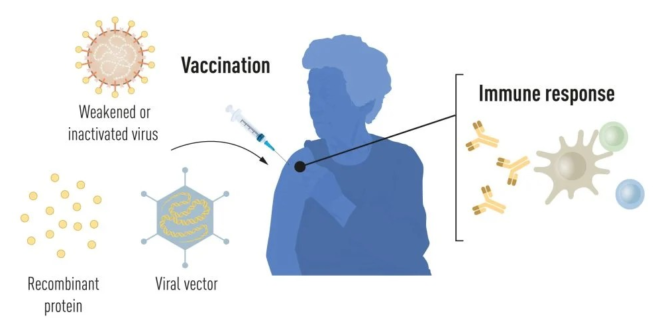
Ilustrasi metode produksi vaksin sebelum pandemi COVID-19.
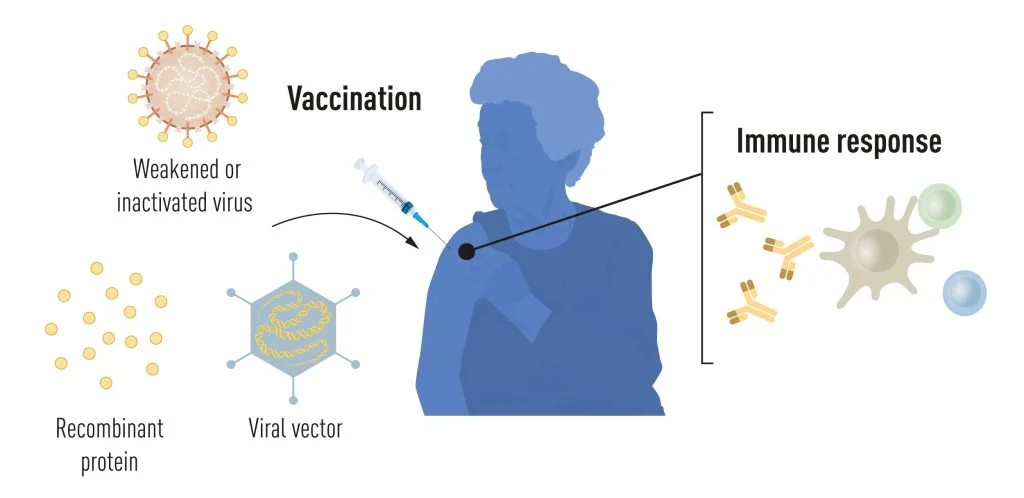
Gambar 1. Metode produksi vaksin sebelum pandemi COVID-19. © Komite Nobel untuk Fisiologi atau Kedokteran. Ill. Mattias Karlén
Vaksin mRNA: Ide yang menjanjikan
Dalam sel kita, informasi genetik yang dikodekan dalam DNA ditransfer ke messenger RNA (mRNA), yang digunakan sebagai template untuk produksi protein. Selama tahun 1980-an, metode yang efisien untuk memproduksi mRNA tanpa kultur sel diperkenalkan, yang disebut transkripsi in vitro. Langkah penentu ini mempercepat pengembangan aplikasi biologi molekuler di beberapa bidang. Gagasan menggunakan teknologi mRNA untuk tujuan vaksin dan terapeutik juga lepas landas, tetapi hambatan terbentang di depan. MRNA yang ditranskripsi secara in vitro dianggap tidak stabil dan menantang untuk diberikan, membutuhkan pengembangan sistem lipid pembawa yang canggih untuk merangkum mRNA. Selain itu, mRNA yang diproduksi secara in vitro menimbulkan reaksi inflamasi. Oleh karena itu, antusiasme untuk mengembangkan teknologi mRNA untuk tujuan klinis pada awalnya terbatas.
Hambatan ini tidak mematahkan semangat ahli biokimia Hungaria Katalin Karikó, yang mengabdikan diri untuk mengembangkan metode untuk menggunakan mRNA untuk terapi. Selama awal 1990-an, ketika dia menjadi asisten profesor di University of Pennsylvania, dia tetap setia pada visinya untuk mewujudkan mRNA sebagai terapi meskipun menghadapi kesulitan dalam meyakinkan penyandang dana penelitian tentang pentingnya proyeknya. Seorang kolega baru Karikó di universitasnya adalah ahli imunologi Drew Weissman. Dia tertarik pada sel dendritik, yang memiliki fungsi penting dalam pengawasan kekebalan dan aktivasi respons imun yang diinduksi vaksin. Didorong oleh ide-ide baru, kolaborasi yang bermanfaat antara keduanya segera dimulai, dengan fokus pada bagaimana berbagai jenis RNA berinteraksi dengan sistem kekebalan tubuh.
Terobosan
Karikó dan Weissman memperhatikan bahwa sel dendritik mengenali mRNA yang ditranskripsi secara in vitro sebagai zat asing, yang mengarah pada aktivasi dan pelepasan molekul pensinyalan inflamasi. Mereka bertanya-tanya mengapa mRNA yang ditranskripsi in vitro diakui sebagai benda asing sementara mRNA dari sel mamalia tidak menimbulkan reaksi yang sama. Karikó dan Weissman menyadari bahwa beberapa sifat kritis harus membedakan berbagai jenis mRNA.
RNA mengandung empat basa, disingkat A, U, G, dan C, sesuai dengan A, T, G, dan C dalam DNA, huruf-huruf kode genetik. Karikó dan Weissman tahu bahwa basa dalam RNA dari sel mamalia sering dimodifikasi secara kimia, sedangkan mRNA yang ditranskripsi in in vitro tidak. Mereka bertanya-tanya apakah tidak adanya basa yang berubah dalam RNA yang ditranskripsi in vitro dapat menjelaskan reaksi inflamasi yang tidak diinginkan. Untuk menyelidiki hal ini, mereka menghasilkan varian mRNA yang berbeda, masing-masing dengan perubahan kimia unik di basa mereka, yang mereka kirim ke sel dendritik. Hasilnya mengejutkan: Respon inflamasi hampir dihapuskan ketika modifikasi basa dimasukkan dalam mRNA. Ini adalah perubahan paradigma dalam pemahaman kita tentang bagaimana sel mengenali dan merespons berbagai bentuk mRNA. Karikó dan Weissman segera mengerti bahwa penemuan mereka memiliki signifikansi mendalam untuk menggunakan mRNA sebagai terapi. Hasil mani ini diterbitkan pada tahun 2005, lima belas tahun sebelum pandemi COVID-19.
Ilustrasi dari empat basa berbeda mRNA mengandung.
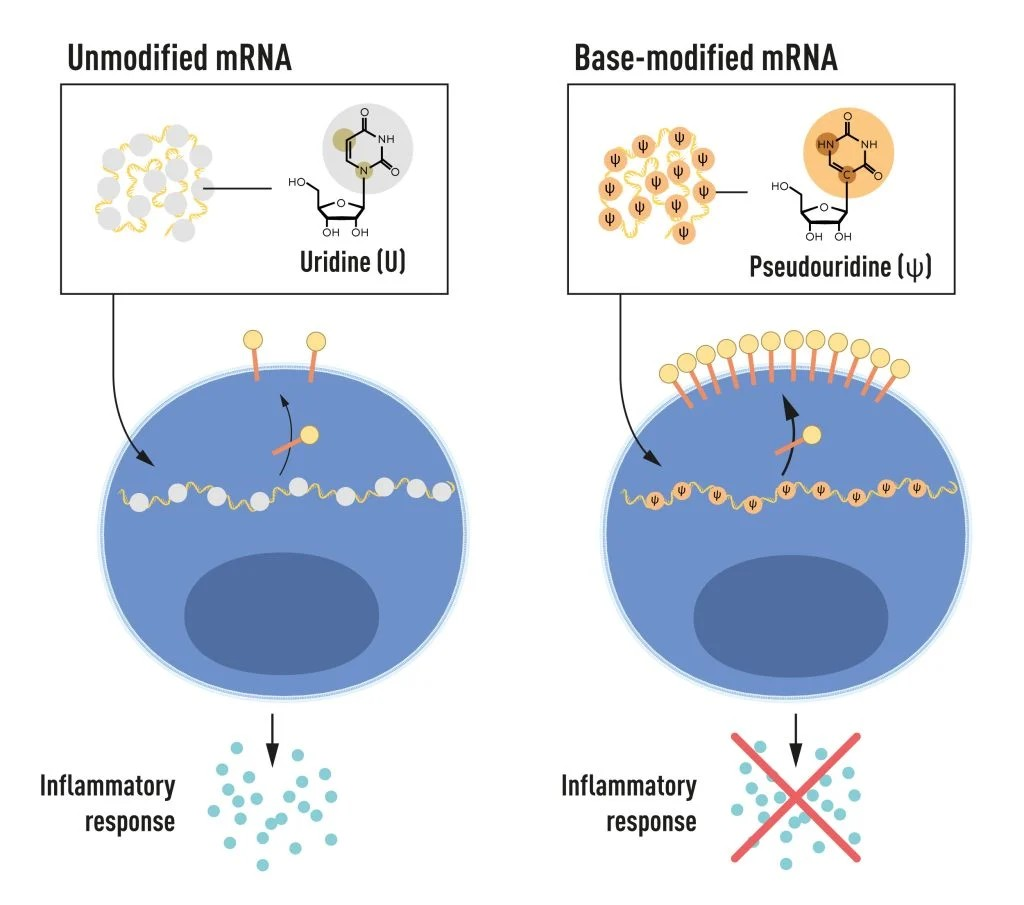
Gambar 2. mRNA berisi empat basa berbeda, disingkat A, U, G, dan C. Peraih Nobel menemukan bahwa mRNA yang dimodifikasi dapat digunakan untuk memblokir aktivasi reaksi inflamasi (sekresi molekul pensinyalan) dan meningkatkan produksi protein ketika mRNA dikirim ke sel. © Komite Nobel untuk Fisiologi atau Kedokteran. Ill. Mattias Karlén
Dalam studi lebih lanjut yang diterbitkan pada tahun 2008 dan 2010, Karikó dan Weissman menunjukkan bahwa pengiriman mRNA yang dihasilkan dengan modifikasi basa secara nyata meningkatkan produksi protein dibandingkan dengan mRNA yang tidak dimodifikasi. Efeknya adalah karena berkurangnya aktivasi enzim yang mengatur produksi protein. Melalui penemuan mereka bahwa modifikasi dasar mengurangi respons inflamasi dan meningkatkan produksi protein, Karikó dan Weissman telah menghilangkan hambatan kritis dalam perjalanan ke aplikasi klinis mRNA.
Vaksin mRNA menyadari potensinya
Ketertarikan pada teknologi mRNA mulai meningkat, dan pada tahun 2010, beberapa perusahaan sedang mengembangkan metode ini. Vaksin terhadap virus Zika dan MERS-CoV dikejar; yang terakhir terkait erat dengan SARS-CoV-2. Setelah pecahnya pandemi COVID-19, dua vaksin mRNA yang dimodifikasi berdasarkan kode protein permukaan SARS-CoV-2 dikembangkan dengan kecepatan tinggi. Efek perlindungan sekitar 95% dilaporkan, dan kedua vaksin disetujui pada awal Desember 2020.
Fleksibilitas dan kecepatan yang mengesankan dengan mana vaksin mRNA dapat dikembangkan membuka jalan untuk menggunakan platform baru juga untuk vaksin terhadap penyakit menular lainnya. Di masa depan, teknologi ini juga dapat digunakan untuk memberikan protein terapeutik dan mengobati beberapa jenis kanker.
Beberapa vaksin lain untuk melawan SARS-CoV-2, berdasarkan metodologi yang berbeda, juga diperkenalkan dengan cepat, dan bersama-sama, lebih dari 13 miliar dosis vaksin COVID-19 telah diberikan secara global. Vaksin telah menyelamatkan jutaan nyawa dan mencegah penyakit parah di lebih banyak lagi, memungkinkan masyarakat untuk membuka dan kembali ke kondisi normal. Melalui penemuan mendasar mereka tentang pentingnya modifikasi dasar dalam mRNA, pemenang Nobel tahun ini secara kritis berkontribusi pada perkembangan transformatif ini selama salah satu krisis kesehatan terbesar di zaman kita.
Publikasi utama
Karikó, K., Buckstein, M., Ni, H. dan Weissman, D. Penindasan Pengakuan RNA oleh Reseptor Toll-like: Dampak modifikasi nukleosida dan asal evolusi RNA. Kekebalan 23, 165–175 (2005).
Karikó, K., Muramatsu, H., Welsh, FA, Ludwig, J., Kato, H., Akira, S. dan Weissman, D. Penggabungan pseudouridine ke dalam mRNA menghasilkan vektor nonimunogenik unggul dengan peningkatan kapasitas translasi dan stabilitas biologis. Mol Ther 16, 1833–1840 (2008).
Anderson, B.R., Muramatsu, H., Nallagatla, S.R., Bevilacqua, P.C., Sansing, L.H., Weissman, D. dan Karikó, K. Penggabungan pseudouridine ke dalam mRNA meningkatkan terjemahan dengan mengurangi aktivasi PKR. Asam nukleat Res. 38, 5884–5892 (2010).
Katalin Karikó lahir pada tahun 1955 di Szolnok, Hongaria. Dia menerima gelar PhD dari Universitas Szeged pada tahun 1982 dan melakukan penelitian pascadoktoral di Akademi Ilmu Pengetahuan Hongaria di Szeged sampai tahun 1985. Dia kemudian melakukan penelitian postdoctoral di Temple University, Philadelphia, dan University of Health Science, Bethesda. Pada tahun 1989, ia diangkat sebagai Asisten Profesor di University of Pennsylvania, di mana ia tetap sampai 2013. Setelah itu, ia menjadi wakil presiden dan kemudian wakil presiden senior di BioNTech RNA Pharmaceuticals. Sejak 2021, ia telah menjadi Profesor di Universitas Szeged dan Profesor Tambahan di Fakultas Kedokteran Perelman di Universitas Pennsylvania.
Drew Weissman lahir pada tahun 1959 di Lexington, Massachusetts, AS. Ia menerima gelar MD, PhD dari Boston University pada tahun 1987. Dia melakukan pelatihan klinis di Beth Israel Deaconess Medical Center di Harvard Medical School dan penelitian postdoctoral di National Institutes of Health. Pada tahun 1997, Weissman mendirikan kelompok penelitiannya di Perelman School of Medicine di University of Pennsylvania. Dia adalah Profesor Keluarga Roberts dalam Penelitian Vaksin dan Direktur Penn Institute for RNA Innovations.
Ilustrasi: © Komite Nobel untuk Fisiologi atau Kedokteran. Ilustrator: Mattias Karlén
Majelis Nobel, yang terdiri dari 50 profesor di Karolinska Institutet, memberikan Hadiah Nobel dalam Fisiologi atau Kedokteran. Komite Nobelnya mengevaluasi nominasi. Sejak 1901 Hadiah Nobel telah diberikan kepada para ilmuwan yang telah membuat penemuan paling penting untuk kepentingan umat manusia.
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia