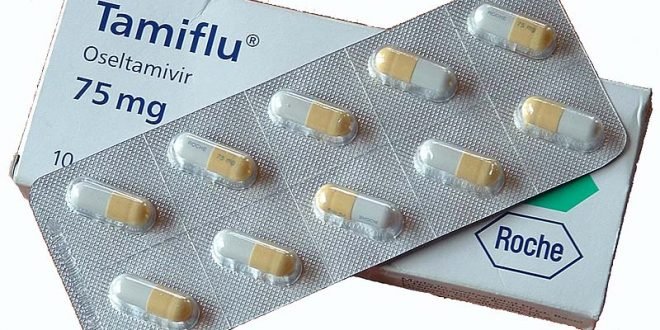
Majalah Farmasetika (V1N6-Agustus 2016). The Food and Drug Administration (FDA) telah menyetujui versi generik pertama oseltamivir fosfat (Tamiflu, Roche Group) pada 3 Agustus 2016. Obat ini digunakan untuk pengobatan antivirus influenza A dan B. Di Indonesia sendiri Tamiflu diedarkan oleh Boehringer Ingelhelm.
Oseltamivir diindikasikan khusus pada pasien usia 2 minggu dan lebih tua yang memiliki gejala flu tidak lebih dari 48 jam. Obat ini juga diindikasikan untuk mencegah influenza pada pasien usia 1 tahun dan lebih tua. Namun, FDA memperingatkan dalam sebuah rilis berita bahwa meskipun oseltamivir dapat diambil sebagai profilaksis, itu bukan pengganti untuk vaksinasi flu.
Mual, muntah, dan sakit kepala adalah beberapa efek samping yang paling umum dilaporkan oleh orang-orang menggunakan oseltamivir dalam uji klinis.
Namun Otoritas kesehatan masyarakat di Amerika dan beberapa peneliti perpendapat bahwa baik oseltamivir serta zanamivir (Relenza, GlaxoSmithKline), antivirus lain untuk wabah flu, perlu uji klinis tambahan untuk menilai efektivitas mereka.
Ketika diambil dalam 48 jam pertama terserang influenza, dua antivirus dihubungkan dengan mengurangi kematian pada pasien rawat inap. Selain itu, mereka muncul untuk mengurangi durasi gejala flu pada sekitar 15 jam, tapi bukti yang ada tidak mendukung penggunaan rutin untuk semua pasien. Kecuali dalam kasus sangat serius, manfaat mungkin tidak sebanding dengan efek samping.
FDA mengatakan dalam siaran pers-nya bahwa ia tidak tahu apakah oseltamivir efektif pada orang yang mulai pengobatan setelah 2 hari dari gejala berkembang atau yang memiliki sistem kekebalan tubuh yang lemah. Badan ini juga mencatat bahwa obat ini tidak mengobati infeksi bakteri yang dapat menyertai flu dan tidak mencegah atau mengobati infeksi lain selain influenza.
Bentuk sediaan dari versi generik baru oseltamivir diproduksi oleh Natco Pharma sama seperti untuk Tamiflu: 30 mg, 45 mg, dan 75 mg.
Sumber :
- http://www.medscape.com/viewarticle/867108
- http://www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm514854.htm
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia