Farmasetika.com – Opini. Badan Pengawas Obat dan Makanan (Badan POM) Republik Indonesia, menindaklanjuti surat edaran informasi awal berupa “Informasi Awal untuk Tenaga Profesional Kesehatan Terkait Keamanan Produk Yang Mengandung Bahan Aktif Ranitidin”. Badan POM menarik 5 produk mengandug ranitidin pada 4 Oktober 2019.
Penarikan tersebut menindak-lanjuti laporan dari US-FDA dan EMA (European Medicines Agency) yang menemuakan adanya kontaminasi (impurities) zat yang beberapa waktu lalu sempat membuat viral jagat kefarmasian yaitu NDMA (Nitrosodimethylamine) pada sampel produk yang mengandung bahan aktif ranitidin.
Praktisi industri farmasi, Bambang Priyambodo, memberikan opini setelah dikeluarkan informasi awal oleh Badan POM pada 24 September 2019 melalui akun facebook pribadinya.
Sejarah penemuan NDMA di produk ranitidin
Pada tanggal 13 Sepetember 2019, US-FDA mengeluarkan “Alert Statement” beberapa produk Ranitidine, termasuk originator-nya yaitu ZANTAC ditemukan telah “tercemar” suatu zat turunan Nitrosamine, yaitu NDMA – suatu bahan yang diklasifikasikan sebagai bahan yang dapat menyebabkan KANKER.
US-FDA (yang kemudian diikuti oleh EMA) segera mengambil langkah cepat dengan mengeluarkan “Alert Statement” untuk melindungi pasien. Meskipun senyawa NDMA yang ditemukan dalam obat Ranitidine tersebut hanya dalam jumlah yang sangat kecil, namun demi prinsip “kehati-hatian”, US-FDA maupun EMA merekomendasikan agar pasien yang mengkonsumsi Ranitidin, disarankan untuk mengganti dengan obat lain.
Badan POM RI keluarkan pernyataan awal
Sikap yang sama juga diambil oleh Badan POM RI yang merekomendasikan agar pasien yang diberi obat Ranitidin diberikan informasi mengenai bahaya penggunaan bahan tersebut. Meskipun tidak ada rekomendasi penarikan maupun penghentian terapi menggunakan bahan ini, namun para profesi kesehatan diminta untuk waspada dan melaporkan terhadap segala efek samping yang ditimbulkan.
Singapura dan Kanada tarik produk ranitidin
Sikap berbeda ditunjukan oleh Otoritas Pengawasan Obat Singapore -Health Science Authority (HSA) – yang langsung mengeluarkan surat recall dan larangan peredaran terhadap 8 merek obat yang mengandung bahan aktif Ranitidine, yaitu Aciloc, Apo-Ranitidine, Hyzan, Neoceptin, Vesyca (film-coated) , Xanidine, Zantac (injection, syrup dan tablet) serta Zynol-150 dari SELURUH klinik, rumah sakit, dan apotek.
Beritanya ada di sini : https://www.straitstimes.com/singapore/health/hsa-stops-supply-of-8-medicines-used-to-treat-heartburn-due-to-cancer-causing
Demikian pula dengan Otoritas Pengawasan Obat di Canada, Health Canada, memerintahkan kepada seluruh distributor maupun produsen untuk sementara waktu menghentikan distribusi SELURUH produk Ranitidine dari peredaran, termasuk Ranitidine produksi “raksasa” Sandoz AG maupun Sanofi SA.
Beritanya di sini : https://www.cbc.ca/news/health/zantac-1.5288242
Apa itu ranitidin?
Ranitidin adalah obat golongan Histamin-2 (H-2) blocker yang diindikasikan untuk pengobatan dan pencegahan kondisi yang disebabkan oleh kelebihan produksi asam lambung seperti gastritis dan ulkus peptikum. Di beberapa negara, seperti Amerika Serikat dan Uni Eropa, obat ini termasuk obat bebas (OTC = Over The Counter) maupun obat yang hanya bisa diperoleh dengan resep dokter (prescription drug).
Sedangkan di Indonesia, obat ini termasuk OBAT KERAS yang hanya bisa diperoleh dengan resep dokter. Untuk itu informasi awal dari BPOM lebih ditujukan untuk tenaga profesional kesehatan, termasuk profesi dokter dan apoteker.
Darimana datangnya NDMA dalam ranitidin?
Tentu menjadi pertanyaan, dari mana datangnya zat NDMA dalam obat dengan bahan aktif Ranitidin tersebut? Mengapa reaksi US-FDA maupun EMA berbeda dengan kasus NDMA sebelumnya yaitu obat Valsartran yang juga ditemukan zat pengotor NDMA pada produk akhirnya. Apakah NDMA yang ditemukan dalam obat Ranitidin “berbeda” dengan zat NDMA yang ditemukan dalam Valsartran? Kalau beda, bedanya di mana? Kalau sama, mengapa “reaksi” US-FDA dan EMA berbeda dengan kasus Valsartan yang dengan serta merta memerintahkan untuk MENARIK seluruh produk Valsartran dari pasaran.
Apa kira – kira akar permasalahannya?
Tugas para apoteker untuk bisa “membedah” kasus ini dari perspective ilmu kefarmasian sehingga bisa memberikan penjelasan yang komprehensif kepada masyarakat.
Dari situs resmi US-FDA, disebutkan bahwa dasar “Alert Statement” diambi setelah dilakukan pengujian terhadap beberapa sampel obat yang mengandung bahan aktif Ranitidine, termasuk ZANTAC – sang originator alias pemilik patent obat yang sudah dipasarkan sejak tahun 1981 ini.
Lihat keterangan lengkapnya di sini :
https://www.fda.gov/news-events/press-announcements/statement-alerting-patients-and-health-care-professionals-ndma-found-samples-ranitidine
Dari peryataan Direktur US-FDA tersebut jelas bahwa temuan NDMA dalam obat Ranitidine tersebut setelah dilakukan pengujian dengan sebuah METODE UJI yang juga tercantum dalam pernyataan tersebut, yaitu menggunakan Metode yang disebut LC-HRMS (Liquid Chromatography – HIGH RESOLUTION Mass Spectrometry), sebuah alat canggih yang mampu “mendeteksi” bahan pengotor (impurities) dengan jumlah yang sangat kecil sekali.
Sesuai dengan laporan yang dilansir oleh US-FDA, metode ini mampu mendeteksi NDMA dalam obat Ranitidine dengan kadar yang sangat kecil. Dari hasil Validasi Metode Analisis Penetapan Kadar NDMA dalam obat Ranitidine, ditemukan bahwa :
– Limit of Detection (LOD) metode ini adalah 0,32 ng/ml atau 0,011 ppm
– Limit of Quantification (LOQ) = 1,0 ng/ml atau 0,033 ppm
– Range : 1,0 – 100 ng/ml atau 0,033 – 3,33 mg
Jadi bisa dibayangkan, betapa SENSITIF-nya metode uji yang dikembangkan oleh US-FDA ini sehingga “kotoran” sebanyak 0,000000032 gram/ml atau 0,011 ppm pun bisa terdeteksi. Sedangkan “impurities” sebanyak 1,0 nano gram/ml atau 0,00000001 g/ml bisa diukur/diuji dengan tepat dan akurat, dengan rentang pengujian 1,0 – 100 ng/ml.
Jadi, adanya temuan NDMA dalam obat Ranitidine ini diperoleh dari Pengembangan Metode Analisa yang dilakukan oleh Center for Drug Evaluation and Research US – FDA, Amerika Serikat, sehingga bisa mendeteksi dan mengukur kadar bahan pencemar NDMA dalam Ranitidin meskipun dalam jumlah sangaaaaat sedikit, jauuuuuh di bawah ambang yang ditetapkan, yaitu 17 microgram/ml.

Jadi, sudah jelas sekarang, awal mula dikeluarkannya “Alert Statement” yang menghebohkan tersebut.
Pertanyaan selanjutnya : dari mana datangnya zat pengotor NDMA tersebut? Apakah sama dengan kasus Valsartran dulu yang disebabkan karena proses produksi bahan baku obat yang diproduksi oleh Zhejiang – Huahai, China yang menyebabkan penarikan besar-besaran obat-obat penurun tekanan darah golongan Sartan beberapa waktu yang lalu?
Kemungkinanan degradasi produk
Dari hasil investigsi yang dilakukan oleh US FDA dan MEA serta beberapa Otoritas Pengawasan Obat di berbagai belahan dunia lainnya, pelan – pelan “misteri” keberadaan NDMA dalam Ranitidine, mulai terkuak.
Dari hasil investigasi, diketahui ternyata Ranitidine yang ditemukan pada tahun 1977 oleh John Bradshaw, peneliti dari The Ware Research Laboratoris – Allen & Hanburys, Glaxo Group di Inggris yang sebagai “respons” atas ditemukannya Cimetidine oleh Prof. Sir James Black – sang pemenang Hadiah Nobel yang kisahnya pernah saya ceritakan beberapa waktu lalu.
Dari hasil penelitian yang sudah pernah dipublikasikan ternyata ada beberapa produk sebagai hasil dekomposisi atau uraian (degradasi) dari Rantidine baik yang disebabkan faktor kinetik maupun mekanik. Salah satunya adalah reaksi antara monochloramine dengan Ranitidine yang menghasilkan zat yang disebut Nitrosodimethylamine (NDMA).

Reaksi degradasi inilah penyebab keberadaan NDMA dalam obat Ranitidine. Karena ”hanya” merupakan hasil degradasi, maka KADAR NDMA dalam produk Ranitidine, jumlahnya sangat kecil sehingga dengan pengujian yang menggunakan metode yang lama tidak terdetesi. Namun dengan perkembangan kemajuan teknologi yang sedemikian luar biasa, termasuk alat – alat deteksi dan alat ukur seperti LC-HRMS (Liquid Chromatography – HIGH RESOLUTION Mass Spectrometry) ini, maka impurities NDMA dengan jumlah yang sangaaaaat keciiiiil pun ternyata bisa terdeteksi dan bisa diukur dengan akurat dan presisi.
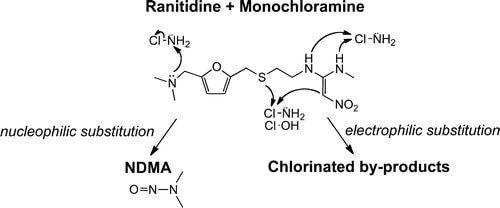
Jadi, berbeda dengan kasus NDMA yang terdapat pada obat Valsartran yang berasal dari proses produksi bahan baku aktif, NDMA yang terdapat pada Ranitidin kemungkinan besar berasal dari hasil degradasi obat, yang mana selama ini memang kurang mendapat perhatian, termasuk dari Farmakope (mana pun) yang tidak dipersyaratkan untuk “menelusuri” apa saja kandungan zat-zat hasil degradasi tersebut.
Apa hubungannya dengan waktu kadaluwarsa?
Sudah tahu kan apa expired date/ED/waktu kedaluwarsa itu? Bagaimana cara menentukan ED? Hal ini sudah pernah saya bahas beberapa waktu lalu (cari sendiri ya… ). Dalam penentuan ED tersebut, waktu ED ditentukan berdasarkan kadar obat (biasanya 90 -110%, tergantung syarat di Kompendial/Farmakope). Jadi obat dikatakan ED, jika kadar obat kurang dari 90% dari label claim. Penurunan kadar tersebut disebabkan banyak hal, termasuk sebab mekanis atau kinetis.
Permasalahan obat yang sudah berkurang kadarnya tersebut kemudian menjadi zat apa? “Zat” inilah yang disebut dengan “Impurrities”. Salah satu impurities dari Ranitidine adalah NDMA ini. Ada banyak literatur yang mengungkapkan bagaimana reaksi degradasi dari Ranitidine tersebut.
Sumber : FB Bambang Priyambodo
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia