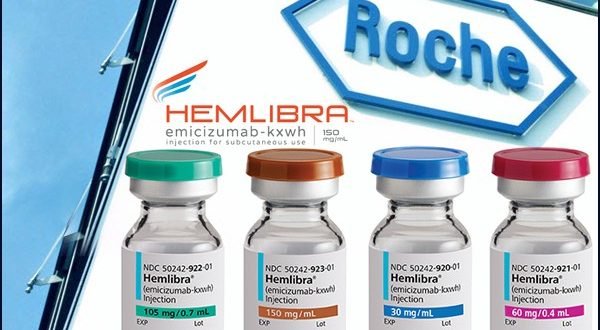
farmasetika.com – Hemlibra (emicizumab) merupakan obat antibodi monoklonal spesifik untuk mengobati penyakit hemofilia A yang mengikat dan menjembatani dua protein yang di aktifkan oleh faktor IX dan faktor X. Faktor-faktor tersebut merupakan faktor antibodi yang sangat penting dalam proses pembekuan darah. Emicizumab merupakan pengobatan profilaksis yang diberikan secara subkutan sekali seminggu3.
Hemlibra (emicizumab) diproduksi dalam bentuk suspensi ataupun larutan yang diadaptasi dari Chinese Hamster Ovary (CHO) cell line. Sumbernya adalah working cell bank (WCB), yang berasal dari master cell bank (MCB). Proses kultur sel untuk produksi zat aktif emicizumab melibatkan tiga tahap: the seed train, the inoculum train, and the production culture. Seed train digunakan untuk menyediakan sumber sel yang berkelanjutan untuk produksi beberapa batch. Inoculum train digunakan untuk memperluas populasi sel untuk dimasukkan ke dalam tahap produksi. Tahap produksi digunakan untuk memproduksi emicizumab, yang disekresikan ke dalam cairan kultur. Selama produksi, kelangsungan hidup sel dan produktivitas ditingkatkan dengan penambahan nutrisi1.
Produk jadi diformulasikan sebagai 30 mg / mL (kekuatan 30 mg) atau 150 mg / mL (mengandung 60 mg, 105 mg, dan 150 mg emicizumab). Dan eksipien yang digunakan adalah L-histidin, asam L-aspartat, L-arginin, poloxamer 188 dan water for injection1.
Pembuatan produk jadi mencakup langkah-langkah proses utama berikut1:
- Pooling beberapa wadah zat aktif dan pencampuran
- Reduksi filtrasi bioburden dari produk jadi
- Filtrasi steril dari produk jadi; mengisi botol dan stoppering
- Capping dan crimping
- Pemeriksaan akhir botol
- Label dan kemasan sekunder
Ringkasan rentang yang dapat diterima yang berasal dari desain proses dan studi validasi telah dilakukan. Rentang tersebut dibenarkan oleh studi desain proses, studi validasi proses, dan media fill runs. Setelah proses produksi, obat emicizumab juga telah melalui proses evaluasi salah satunya adalah uji stabilitas1.
Proses transfer teknologi dilakukan oleh Roche kepada Dobrolek LLC (part of Farmeko Group). Roche akan memastikan transfer teknologi untuk produksi emicizumab, termasuk metode kontrol kualitas, dan pasokan produk dalam jumlah besar yang diperlukan untuk produksi ke Federasi Rusia. Pada gilirannya, Dobrolek mengatur produksi sesuai dengan Aturan Praktek Manufaktur yang Baik (GMP), serta penyimpanan dan distribusi obat di Federasi Rusia2.
Emicizumab akan diproduksi di fasilitas Dobrolek LLC di Moskow dalam bentuk larutan untuk pemberian subkutan 150 mg / ml dan 30 mg / ml. Batch pertama emicizumab akan memasuki pasar Rusia pada September 20202.
Referensi
- European Medicines Agency. 2018. Hemlibra International non-proprietary name: emicizumab. Assesment Report. European Medicines Agency: London.
- GMP News. 2019. Roche and Dobrolek Agreed on Localization of Innovative Drug Production in Russia. Tersedia online di https://gmpnews.net/2019/09/roche-and-dobrolek-agreed-on-localization-of-innovative-drug-production-in-russia/ [Diakses pada tanggal 27 Oktober 2019].
- Kitazawa T dan Shima M. 2018. Emicizumab, a humanized bispecific antibody to coagulation factors IXa and X with a factor VIIIa-cofactor activity. International Journal of Hematology.
Penulis : Riska Nurul Hidayah, Mahasiswa Program Studi Sarjana Farmasi, Universitas Padjadjaran
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia