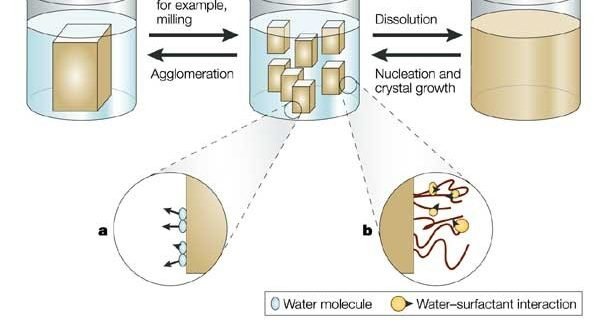
Majalah Farmasetika – Beberapa tahun terakhir penelitian baru tentang penghantaran obat yang ditinjau dari entitas kimia mengalami peningkatan tetapi masalah utama dari sebagian besar zat aktif adalah sulit atau tidak dapat larut dalam air.
Lebih dari 40% kandidat memiliki kelarutan yang buruk dalam air, dan membuat kandidat obat tersebut memiliki bioavaibilitas yang rendah (Gebremedhin et al., 2014). Beberapa metode digunakan untuk mengatasi masalah ini, seperti: preparasi kandidat obat dalam sediaan nanosuspensi dengan menggunakan melakukan preparasi seperti menggunakan pelarut campuran, mengadopsi teknologi inklusi dan mikronisasi, atau dibuat menjadi emulsi intravena.
Namun metode ini memiliki beberapa kendala, seperti, metode pelarut campur membutuhkan obat yang memiliki sifat fisik dan kimia tertentu seperti harus dapat dilarutkan dalam beberapa pelarut organik. Teknologi inklusi mensyaratkan obat memiliki ukuran molekul yang sesuai dan untuk metode mikronisasi tidak dapat meningkatkan bioavaibilitas yang berarti (Tran et al., 2015).
Apa itu nanosuspensi?
Pendekatan baru dilakukan untuk mengatasi masalah tersebut yaitu spesifik pada ukuran partikel dan massa jenis dari kandidat obat. Nanosuspensi telah dianggap sebagai pendekatan yang kuat untuk pengiriman obat senyawa yang tidak larut dalam air.
Nanosuspensi adalah sejenis sistem obat partikel murni yang merupakan dispersi koloid sub-mikron, dengan surfaktan sebagai agen suspensi (Kuntsche dan Bunjes, 2007). Nanosuspensi dapat digunakan untuk sediaan obat yang tidak larut dalam air tetapi larut dalam minyak, meskipun nantinya dapat menggunakan sistem lipid seperti sediaan liposom dan emulsi.
Dibandingkan dengan sistem lipid, nanosuspensi juga berhasil merumuskan obat yang memiliki kelarutan yang buruk baik dalam air maupun minyak dalam sediaan. Nanosuspensi mengatasi kelemahan obat terlarut sebelum preparasi, dimana preparasi perlu mempertahankan kondisi kristalisasi terbaik dan ukurannya cukup kecil (Yao et al., 2012).
Kelebihan nanosuspensi
Keuntungan nanosuspensi telah membawa banyak kemudahan dan manfaat bagi orang-orang. Seperti, penggunaan obat intravena yang dapat menurunkan toksisitas dan meningkatkan efek kuratif serta dapat meningkatkan waktu paruh obat.
Dengan mengurangi ukuran partikel obat mengalami peningkatan dalam derajat kelarutan. Ukuran partikel yang rendah dapat meningkatkan stabilitas fisika sedimentasi. Jadi nanosuspensi sama sekali berbeda dari obat pembawa koloid polimer nanopartikel.
Keunggulan lain dari bentuk sediaan ini adalah menghasilkan adhesi biologis serta meningkatkan stabilitas kimiawi (Otsuka et al., 2012). Preparasi nanosuspensi telah dikembangkan oleh peneliti asing untuk meningkatkan ketersediaan hayati obat yang sulit larut. Salah satu tantangan utama dalam mencapai tujuan ini adalah menemukan pendekatan preparasi nanosuspensi yang sesuai dengan input energi rendah dan kontaminasi erosi, seperti metode bottom-up (Wu et al., 2011)
Teknologi bottom-up untuk preparasi nanosuspensi
1. Presipitasi-ultrasonication
Dalam beberapa tahun terakhir, USG telah diakui sebagai metode yang hebat dalam mengendalikan proses nukleasi dan kristalisasi. Iradiasi ultrasound dapat membantu mengintensifkan transfer massa dan mempercepat difusi molekul (Zeng dan Weber, 2014). Dengan input daya ultrasonik membuat ukuran kristal menurun. Selain itu, lamanya waktu perlakuan dengan ultrasonik juga berpengaruh terhadap ukuran partikel. Ketika waktu ultrasonication ditingkatkan, ukuran partikelnya cukup berkurang.
Diketahui bahwa kristalisasi protein dapat terjadi dalam kondisi jenuh, meskipun diobati dengan ultrasonikasi. Indeks polidispersitas, kualitas nanopartikel dan ukuran Z-Average yang lebih kecil dapat ditingkatkan secara signifikan dengan penerapan ultrasonication pada suspensi milled. Telah diteliti bahwa ukuran dan keadaan dispersi nanopartikel yang dipreparasi benar-benar dapat dipengaruhi oleh ultrasonication yang dapat diukur oleh fitur morfologi nanopartikel TEM (Patel et al., 2014).
2. Presipitasi Nano Flash Presipitasi
Flash Nano (FNP) sebagai teknologi bottom-up dengan kemampuan mengontrol produksi nanopartikel organik. Confined impinging jets mixer (CIJM) atau Multi-inlet vortex mixer (MIVM) sebagai mixer yang didesain khusus digunakan untuk mencapai pencampuran yang efisien dari semua komponen dalam campuran pelarut. Untuk membuat pembentukan nanopartikel dengan cepat, karakteristik nukleasi dan skala waktu yang lebih sedikit (Dannemann et al., 2010).
3. Pengendapan antisolvent
Pengendapan antisolvent merupakan cara yang efektif untuk membuat obat ukuran mikro atau nano. Pada metode pengendapan ini, pertama obat dilarutkan dalam pelarut, kemudian larutan yang mengandung obat dengan cepat ditambahkan ke dalam anti pelarut (Lee et al., 2008). Pengendapan kristal terjadi dalam kondisi konsentrasi jenuh obat yang disebabkan oleh desolvasi.
Selama pengendapan obat dalam anti-pelarut, pembentukan awal nanopartikel biasanya berbentuk amorf dan tidak stabil di bawah kondisi jenuh. Sehingga akan muncul sebaran ukuran partikel yang besar dan luas (Zabihi et al., 2015).
Untuk mendapatkan ukuran partikel dan distribusi ukuran partikel yang sesuai, beberapa pengukuran dapat dilakukan, yaitu proporsi fasa organik dan fasa ant-solvent; kecepatan pencampuran dua fase; konsentrasi obat utama; suhu pembentukan dan pertumbuhan inti kristal; jenis stabilisator; proporsi penstabil dan obat-obatan; dan seterusnya (Phromviyo et al., 2014).
Untuk membuat nanosuspensi yang memiliki stabilitas baik; stabilizer yang digunakan harus memiliki afinitas yang cukup untuk permukaan partikel dan memiliki difusivitas tinggi yang dapat dengan cepat menutupi permukaan yang dihasilkan. Selain itu, jumlah bahan penstabil harus mampu menutupi seluruh permukaan partikel (Jannoo et al., 2015). Pada saat yang sama, temperatur juga mempengaruhi ukuran partikel dalam beberapa aspek.
Jika suhunya tinggi akan menyebabkan, kelarutan obat akan meningkat dan juga akan menyebabkan tingkat kejenuhan berkurang, sehingga menyebabkan kristalisasi yang tersedia berkurang. Di sisi lain, jika terjadi nukleasi, lebih banyak molekul terlarut akan mendorong pembentukan kristal yang cepat (Sipoli et al., 2015).
Karakterisasi Nanosuspensi
1. Ukuran Partikel Dan Distribusi Ukuran Partikel
Sifat fisikokimia seperti ukuran partikel, distribusi ukuran, morfologi, keadaan kristal obat, potensi zeta, pelepasan in vitro dan stabilitas plasma dievaluasi untuk melihat stabilitas dari sediaan nanosuspensi. Dan ada beberapa metode seperti laser difraksi (LD), hamburan cahaya dinamis (DLS), fraksinasi aliran medan, analisis pelacakan partikel tunggalion, penginderaan oklusi, dan mikroskop cahaya dan elektron semuanya cocok untuk penentuan ukuran partikel (Menz et al., 2012). Hamburan cahaya dinamis yang juga dikenal dengan PCS biasanya dilakukan dengan menggunakan zetasizer Nano ZS, dan memiliki pengaruh terhadap ukuran partikel rata-rata, distribusi ukuran, dan potensi zeta dari nanopartikel pada suhu kamar (Gallego-Urrea et al., 2011).
2. Pengukuran potensial zeta
Diketahui bahwa muatan permukaan dari nanosuspensi juga dapat dikarakterisasi dengan nilai potensial zeta. Potensi zeta dapat diukur dengan Zetasizer. Air Milli-Q obat mencapai konsentrasi akhir yang sesuai dan kemudian dimasukkan ke dalam sel elektroforetik. Selanjutnya kondisi muatan partikel dapat sepenuhnya dikarakterisasi dalam media dispersi asli (Kumar et al., 2014).
3. Karakterisasi keadaan kristal
X-Ray Diffraction (XRD) dan Differential Scanning Calorimetry (DSC) adalah dua metode yang dapat mengevaluasi kristalinitas nanopartikel obat. DSC dapat memberikan informasi termodinamika obat, dan dengan kemampuannya mengidentifikasi perubahan suhu titik leleh dan entalpi dan X-RD dapat menganalisis pembentukan kristal atau amorf yang diukur menggunakan sinar X (Ganapathy et al., 2009).
4. Morfologi Permukaan
Mikroskop cahaya adalah sejenis alat optik yang menggunakan prinsip optik untuk memperbesar gambar objek kecil yang tidak dapat dibedakan oleh mata manusia. Ini bisa digunakan untuk mengevaluasi morfologi partikel nanosuspensi. Karakterisasi morfologi juga dapat digambarkan melalui mikroskop elektron transmisi (TEM) dan scanning electron microscopy (SEM) (Mauludin et al., 2009).
Sifat Obat Nanosuspensi dan Produksinya
Untuk meningkatkan eksposur yang tidak perlu pada organ lain dari yang ditargetkan dengan biaya pengobatan rendah, metode termudah dari masalah kelarutan diselesaikan untuk meningkatkan ketersediaan hayati dan untuk mengurangi dosis (Wei et al., 2014). Nanosuspensi menawarkan solusi yang mudah, sederhana dan hemat biaya untuk menyelesaikan semua masalah di atas. Nanosuspensi juga dapat dianggap sebagai pendekatan formulasi yang relevan secara industri karena kemampuannya mengatasi masalah yang terkait dengan sistem penghantaran obat lain seperti toksisitas polimer, enkapsulasi rendah, stabilitas dan masalah biokompatibilitas (Ji et al., 2015).
Obat yang sulit larut dapat diproduksi oleh teknologi “top-down” atau “bottom-up”, atau keduanya. Metode pendekatan bottom-up yaitu memperkecil ukuran partikel dari molekul obat terlarut dalam larutan organik. Dalam proses ini, pembentukan nanosuspensi memiliki dua tahapan yaitu penampilan dan pertumbuhan inti kristal (Sedighi dan Mohebbi, 2014).
Dua fase dipengaruhi oleh suhu; suhu nukleasi yang ideal harus lebih rendah dari suhu pertumbuhan. Caranya, fluida suspensi ditekan melalui lubang-lubang katup bertekanan tinggi, suspensi yang memiliki aliran berkecepatan tinggi akan menyebabkan terbentuknya gelembung-gelembung uap air. Kemudian partikel tersebut terurai oleh gelombang yang diinduksi.
Penggilingan basah sebagai teknik manufaktur lain untuk menyiapkan nanosuspensi, bahan aktif dihancurkan dengan media penggilingan di bawah penstabil permukaan. Selain itu, obat dilarutkan dalam pelarut organik yang mudah menguap kemudian disemprotkan ke dalam larutan air yang dipanaskan, dengan adanya surfaktan, penguapan pelarut dengan cepat dan membuat pengendapan obat (Srinivasan dan Smith, 2012).
Stabilitas nanosuspensi
Agregasi telah dianggap sebagai masalah stabilitas yang lebih penting selama penyimpanan. Selama penyimpanan atau proses pemadatan dengan penstabil yang tidak sesuai memungkinkan nanosuspensi tidak selalu stabil. Dalam nanosuspensi, partikel yang lebih kecil dapat muncul aglomerasi yang disebabkan oleh stabilisator yang tidak sesuai karena fenomena pematangan Ostwald (Rahaiee et al., 2015).
Selain itu, untuk menghindari perbedaan besar dalam kelarutan dari berbagai ukuran kristal, ukuran partikel nanosuspensi yang dibuat harus relatif homogen. Stabilizer yang tepat dapat digunakan untuk menghasilkan suspensi nano yang stabil. Potensi interaksi penstabil tertentu dengan senyawa obat berpengaruh besar terhadap efisiensinya (Tomoda et al., 2014).
Untuk menjaga kestabilan permukaan, beberapa tindakan dilakukan untuk mencegah terbentuknya agregasi dan pengendapan yang disebabkan oleh energi permukaan yang tinggi. Untuk menjaga agar keadaan partikel tetap terpisah, tolakan elektrostatis sebagai metode digunakan untuk nanokristal tanpa muatan permukaan, dengan surfaktan anionik seperti natrium lauril sulfat, odium deoksikolat dan natrium kolat (Luo et al., 2015). Selain itu, menetapkan penghalang sterik sebagai cara lain untuk melawan agregasi.
Cara lain juga adalah penggunaan stabilisator polimer di permukaannya untuk menjaga stabilitas partikel nano. Turunan dari selulosa, polivinil alkohol, polivinil pyrrolidone, Polysorbate (polyoxyethylene Sorbian fatty acid esters), Pluronics (atau Poloxamers, polyoxyethylenean dan tailbacks copolymers of polyoxypropylene) digunakan untuk tujuan ini.
Tetapi beberapa stabilisator aktif secara biologis yang memberikan fungsi tambahan pada nano partikel, seperti asam amino amfifilik polietilen glikol suksinat (TPGS), kopolimer, arginin dan vitamin E. Selain itu, efektivitas penstabil juga terkait dengan afinitas suatu obat, konsentrasi dan penstabil terhadap rasio obat dalam suspensi (Makhlof et al., 2008).
Sumber :
Dannemann, J., Pielhop, K., Klaas, M., Schröder, W., 2010. Cycle resolved multi-planar flow measurements in a four-valve combustion engine. Exp. Fluids 50, 961-976.
Gallego-Urrea, J.A., Tuoriniemi, J., Hassellöv, M., 2011. Applications of particle-tracking 30 analysis to the determination of size distributions and concentrations of nanoparticles in environmental, biological and food samples. Trac-Trend. Anal. Chem. 30, 473-483.
Ganapathy, H.S., Park, S.Y., Lee, W.-K., Park, J.M., Lim, K.T., 2009. Polymeric nanoparticles from macroscopic crystalline monomers by facile solid-state polymerization in supercritical CO2. J. Colloid Interf. Sci. 51, 264-269.
Gebremedhin, S., Singh, A., Koons, S., Bernt, W., Konopka, K., Duzgunes, N., 2014. Gene delivery to carcinoma cells via novel non-viral vectors: Nanoparticle tracking analysis and suicide gene therapy. Eur. J. Pharm. Biopharm. 60, 72-79.
Jannoo, K., Teerapatsakul, C., Punyanut, A., Pasanphan, W., 2015. Electron beam assisted synthesis of silver nanoparticle in chitosan stabilizer: Preparation, stability and inhibition of building fungi studies. Radiat. Phys. Chem. 112, 177-188.
Ji, N., Li, X., Qiu, C., Li, G., Sun, Q., Xiong, L., 2015. Effects of heat moisture treatment on the physicochemical properties of starch nanoparticles. Carbohyd. Polym. 117, 605-609.
Kumar, S., Xu, X., Gokhale, R., Burgess, D.J., 2014c. Formulation parameters of crystalline nanosuspensions on spray drying processing: a DoE approach. Int. J. Pharm. 464, 34-45.
Kuntsche, J., Bunjes, H., 2007. Influence of preparation conditions and heat treatment on the properties of supercooled smectic cholesteryl myristate nanoparticles. Eur. J. Pharm. Biopharm. 67, 612-620.
Lee, L.Y., Wang, C.H., Smith, K.A., 2008. Supercritical antisolvent production of biodegradable micro- and nanoparticles for controlled delivery of paclitaxel. J. Control. Release 125, 96-106.
Makhlof, A., Miyazaki, Y., Tozuka, Y., Takeuchi, H., 2008. Cyclodextrins as stabilizers for the preparation of drug nanocrystals by the emulsion solvent diffusion method. Int. J. Pharm. 357, 280-285.
Mauludin, R., Müller, R.H., Keck, C.M., 2009. Development of an oral rutin nanocrystal formulation. Int. J. Pharm. 370, 202-209.
Menz, W.J., Shekar, S., Brownbridge, G.P.E., Mosbach, S., Körmer, R., Peukert, W., Kraft, M., 2012. Synthesis of silicon nanoparticles with a narrow size distribution: A theoretical study. J. Aerosol Sci. 44, 46-61.
Otsuka, H., Nagasaki, Y., Kataoka, K., 2012. PEGylated nanoparticles for biological and pharmaceutical applications. Adv. Drug Deliver. Rev. 64, 246-255.
Patel, C.M., Chakraborty, M., Murthy, Z.V.P., 2014. Preparation of fenofibrate nanoparticles by combined stirred media milling and ultrasonication method. Ultrason. Sonochem. 21, 1100-1107.
Phromviyo, N., Swatsitang, E., Chompoosor, A., 2014. Effect of a surface stabilizer on the formation of polyoxalate nanoparticles and their release profiles. Vacuum 107, 208-212.
Rahaiee, S., Shojaosadati, S.A., Hashemi, M., Moini, S., Razavi, S.H., 2015. Improvement of crocin stability by biodegradeble nanoparticles of chitosan-alginate. Int. J. Biol. Macromol. 79, 423-432.
Sedighi, M., Mohebbi, A., 2014. Investigation of nanoparticle aggregation effect on thermal properties of nanofluid by a combined equilibrium and non-equilibrium molecular dynamics simulation. J. Mol. Liq. 197, 14-22.
Sipoli, C.C., Radaic, A., Santana, N., de Jesus, M.B., de la Torre, L.G., 2015. Chitosan nanoparticles produced with the gradual temperature decrease technique for sustained gene delivery. Biochem. Eng. J. 103, 114-121.
Srinivasan, R., Smith, K., 2012. Additional wet milling step for fractionation of barley flour after hull separation. J. Cereal Sci. 56, 248-252
Tomoda, K., Yabuki, N., Terada, H., Makino, K., 2014. Surfactant free preparation of PLGA nanoparticles: The combination of antisolvent diffusion with preferential solvation. Colloid. Surface. A 457, 88-93.
Tran, T.T.-D., Tran, K.A., Tran, P.H.-L., 2015. Modulation of particle size and molecular interactions by sonoprecipitation method for enhancing dissolution rate of poorly water-soluble drug. Ultrason. Sonochem. 24, 256-263.
Wei, Y., Li, L., Xi, Y., Qian, S., Gao, Y., Zhang, J., 2014. Sustained release and enhanced bioavailability of injectable scutellarin-loaded bovine serum albumin nanoparticles. Int. J. Pharm. 476, 142-148.
Wu, L., Zhang, J., Watanabe, W., 2011. Physical and chemical stability of drug nanoparticles. Adv. Drug Deliver. Rev. 63, 456-469.
Yao, L., Zhao, X., Li, Q., Zu, Y., Fu, Y., Zu, B., Meng, X., Liu, C., 2012. In vitro and in vivo evaluation of camptothecin nanosuspension: A novel formulation with high antitumor 41 efficacy and low toxicity. Int. J. Pharm. 423, 586-588.
Zabihi, F., Yang, M., Leng, Y., Zhao, Y., 2015. PLGA–HPMC nanoparticles prepared by a modified supercritical anti-solvent technique for the controlled release of insulin. J. Supercrit. Fluid. 99, 15-22Zeng, L., Weber, A.P., 2014. Aerosol synthesis of nanoporous silica particles with controlled pore size distribution. J. Aerosol Sci. 76, 1-12.
Penulis : Faradila Ratu Cindana Mo’o, Mahasiswa Magister Ilmu Farmasi, Fakultas Farmasi, Universitas Padjadjaran
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia