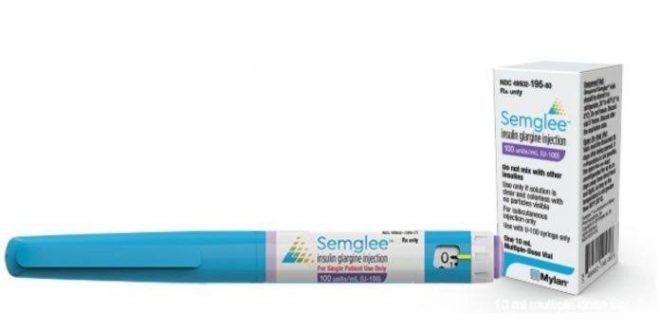
Majalah Farmasetika – Food and Drug Administration (FDA) AS telah menyetujui insulin pertama yang dapat dipertukarkan, Semglee (Mylan Pharmaceuticals), yang dapat menggantikan glargine (Lantus, Sanofi) di apotek tanpa memerlukan resep terpisah.
Persetujuan tersebut akan memungkinkan Semglee berfungsi seperti obat generik di pasaran dan dapat mengurangi biaya insulin.
Hal ini diindikasikan untuk meningkatkan kontrol glikemik pada orang dewasa dan pasien anak dengan diabetes tipe 1 dan pada orang dewasa dengan diabetes tipe 2.
Awalnya disetujui pada bulan Juni 2020 sebagai biosimilar dengan glargine, Semglee sekarang menjadi “biosimilar yang dapat dipertukarkan”, yang berarti bahwa ia tidak memiliki perbedaan yang bermakna secara klinis dari produk referensi dan juga dapat menggantikan produk tersebut — dalam hal ini, glargine (Lantus) — tanpa intervensi resep, seperti obat generik biasanya, tunduk pada undang-undang farmasi negara bagian di AS.
Untuk persetujuan sebagai biosimilar yang dapat dipertukarkan, produsen harus memberikan data tambahan yang mencerminkan bagaimana biosimilar yang dapat dipertukarkan dapat digunakan di pasar dengan pasien.
“Akses ke insulin yang terjangkau sangat penting dan produk insulin kerja panjang, seperti insulin glargine, memainkan peran penting dalam pengobatan diabetes mellitus tipe 1 dan 2,” kata Peter Stein, MD, direktur Office of New Drugs di FDA. Pusat Evaluasi dan Penelitian Obat, dalam pernyataan FDA.
“Standar persetujuan FDA yang tinggi berarti profesional kesehatan dan pasien dapat yakin akan keamanan dan keefektifan produk biosimilar yang dapat dipertukarkan, seperti yang mereka lakukan untuk produk referensi.”
“Produk biosimilar dan biosimilar yang dapat dipertukarkan memiliki potensi untuk mengurangi biaya perawatan kesehatan, mirip dengan bagaimana obat generik telah mengurangi biaya. Biosimilar yang dipasarkan di AS biasanya telah diluncurkan dengan harga jual awal 15% hingga 35% lebih rendah dari harga daftar komparatif dari produk referensi ,” catat FDA dalam pernyataan mereka.
Semglee hadir dalam botol 10 mL dan pena 3 mL yang telah diisi sebelumnya, dan diberikan secara subkutan sekali sehari, dengan dosis individual. Efek samping yang paling umum adalah hipoglikemia, edema, lipodistrofi, penambahan berat badan, dan reaksi alergi.
FDA merilis materi baru untuk penyedia layanan kesehatan mengenai produk biosimilar dan yang dapat dipertukarkan, termasuk lembar fakta tentang produk biosimilar yang dapat dipertukarkan.
Sumber
FDA Approves First Interchangeable Biosimilar Insulin Product for Treatment of Diabetes https://www.fda.gov/news-events/press-announcements/fda-approves-first-interchangeable-biosimilar-insulin-product-treatment-diabetes
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia