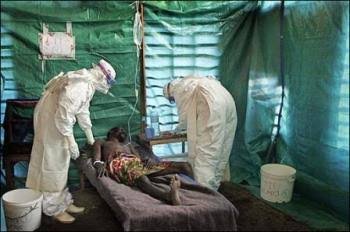
Farmasetika.com – Badan Pengawas Obat dan Makanan Amerika Serikat (Food and Drig Administeation/FDA) telah menyetujui vaksin pertama untuk pencegahan Ebola yang disebabkan oleh jenis virus Zaire yang mematikan, yang menewaskan lebih dari 11.000 orang selama wabah di Afrika Barat tahun 2014 dan berada di belakang lebih dari 2200 kematian di negara itu. wabah saat ini di Republik Demokratik Kongo timur (DRC).
Ervebo dari Merck
Vaksin yang disebut Ervebo dari Merck & Co adalah untuk individu berusia 18 tahun ke atas. Ini diberikan sebagai suntikan dosis tunggal, dan merupakan vaksin hidup yang dilemahkan yang telah direkayasa secara genetik untuk mengandung protein dari virus ebola di Zaire.
Ebola “tidak mengenal batas. Vaksinasi sangat penting untuk membantu mencegah wabah dan menghentikan penyebaran virus Ebola ketika wabah terjadi,” kata Peter Marks, MD, PhD, direktur Pusat Evaluasi dan Penelitian Biologi FDA, dalam sebuah pernyataan.
“Persetujuan FDA terhadap Ervebo adalah kemajuan besar dalam membantu melindungi terhadap virus Zaire serta memajukan upaya kesiapan pemerintah AS,” kata Marks.
Alex Azar, sekretaris, Departemen Kesehatan & Layanan Kemanusiaan AS (HHS), menyebut persetujuan FDA untuk vaksin melawan Ebola sebagai “kemenangan kepemimpinan kesehatan global di Amerika.”
“Tonggak Sejarah” Dalam Upaya Kesiapan dan Pencegahan.
Hasil uji klinis
Vaksin Ervebo diuji di Guinea selama wabah 2014-2016 pada orang dewasa 18 tahun dan lebih tua. Sebanyak 3.537 kontak, dan kontak kontak, dari orang-orang dengan penyakit virus Ebola yang dikonfirmasi laboratorium (EVD) menerima vaksinasi segera atau tertunda 21 hari dengan Ervebo.
Dalam membandingkan kasus EVD di antara 2108 orang di kelompok vaksinasi langsung dan 1429 orang di kelompok vaksinasi tertunda, Ervebo ditemukan 100% efektif dalam mencegah kasus Ebola dengan onset gejala lebih dari 10 hari setelah vaksinasi.
Tidak ada kasus EVD dengan onset gejala lebih dari 10 hari setelah vaksinasi diamati pada kelompok cluster langsung, dibandingkan dengan 10 kasus EVD pada kelompok cluster tertunda 21 hari.
Keamanan Ervebo dinilai pada sekitar 15.000 orang di Afrika, Eropa, dan Amerika Utara. Efek samping yang paling umum adalah rasa sakit, bengkak, dan kemerahan di tempat suntikan, serta sakit kepala, demam, nyeri sendi dan otot, dan kelelahan.
FDA memberikan ulasan prioritas dan penunjukan terapi terobosan untuk Ervebo.
Disetujui komisi Eropa
Vaksin ini disetujui oleh Komisi Eropa pada bulan November, menyusul pendapat positif oleh Komite Badan Obat Eropa untuk Produk Obat untuk Penggunaan Manusia pada bulan Oktober, seperti yang dilaporkan oleh Medscape Medical News.
“Memiliki vaksin Ebola yang disetujui oleh FDA adalah tonggak penting dalam kesiapsiagaan dan upaya pencegahan Ebola,” Rick Bright, PhD, wakil asisten sekretaris untuk kesiapsiagaan dan tanggapan dan direktur Badan Penelitian dan Pengembangan Biomedis Lanjutan (BARDA), mengatakan dalam sebuah pernyataan dari Merck.
“Di BARDA, kami sangat bangga telah menjadi bagian dari kolaborasi yang belum pernah terjadi sebelumnya antara sektor swasta dan publik di berbagai negara yang telah mengarah pada momen penting ini dalam sejarah kesehatan masyarakat, “kata Bright.
Merck bekerja untuk mulai memproduksi dosis Ervebo berlisensi dan mengharapkan dosis ini mulai tersedia pada kuartal ketiga tahun 2020.
Selama masa transisi ini, Merck terus bekerja sama dengan para mitra untuk memastikan akses yang tidak terputus ke vaksin Ebola Zaire (V920) yang sedang diselidiki untuk mendukung upaya tanggapan internasional yang sedang berlangsung di DRC dan negara-negara tetangga.
Hingga saat ini, perusahaan telah mengirimkan lebih dari 275.000 dosis vaksin V920 yang sedang diselidiki berdasarkan permintaan dari Organisasi Kesehatan Dunia.
Sumber : FDA OKs First Vaccine Against Deadly Ebola Virus. https://www.medscape.com/viewarticle/922973
 Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia
Info Farmasi Terkini Berbasis Ilmiah dan Praktis Majalah Farmasi Online Pertama di Indonesia